 歡迎來到北京博奧森生物技術(shù)有限公司網(wǎng)站!
歡迎來到北京博奧森生物技術(shù)有限公司網(wǎng)站! 歡迎來到北京博奧森生物技術(shù)有限公司網(wǎng)站!
歡迎來到北京博奧森生物技術(shù)有限公司網(wǎng)站!


發(fā)表期刊:Advanced Functional Materials
IF:19
一作單位:南方醫(yī)科大學(xué)第十附屬醫(yī)院
研究背景
免疫療法通過靶向免疫檢查點(diǎn)阻斷(ICB)技術(shù),重新激活潛伏的癌癥免疫系統(tǒng),實(shí)現(xiàn)全身性的腫瘤清除。然而,95%的結(jié)直腸癌(CRC)病例在微衛(wèi)星不穩(wěn)定性檢測中呈陰性,這會引發(fā)免疫系統(tǒng)的嚴(yán)重抑制和T細(xì)胞的大量消耗,從而形成免疫抑制性腫瘤微環(huán)境(ITM),并導(dǎo)致對ICB所用的單抗產(chǎn)生低過敏性免疫反應(yīng)。PD-1/PD-L1抗體耐藥性產(chǎn)生的重要因素在于T細(xì)胞免疫球蛋白黏蛋白-3(TIM3)的上調(diào)。作為新型免疫檢查點(diǎn)分子,TIM3不僅能抑制T細(xì)胞活性,還能特異性破壞HMGB1誘導(dǎo)腫瘤細(xì)胞免疫性死亡的能力。
CRISPR/Cas13a是一種RNA核酸內(nèi)切酶,除了作為強(qiáng)大的RNA編輯工具外,還具有開發(fā)成癌癥治療系統(tǒng)的潛力。在crRNA引導(dǎo)下特異性識別后,Cas13a會對目標(biāo)基因?qū)嵤?qiáng)效RNA沉默,并通過“旁系切割效應(yīng)"進(jìn)一步促進(jìn)腫瘤細(xì)胞死亡,有效抵抗腫瘤的應(yīng)激反應(yīng)逃逸機(jī)制。Cas13a系統(tǒng)靶向RNA而非基因組DNA,因此不會引發(fā)額外的突變。此外,Cas13a在靶向單鏈RNA轉(zhuǎn)錄前不具備切割活性,這使得通過篩選腫瘤中過表達(dá)的目標(biāo)基因,能夠實(shí)現(xiàn)高度的生物安全性。盡管CRISPR/Cas13a在多靶點(diǎn)癌癥治療中優(yōu)勢顯著,但為了避免體內(nèi)持續(xù)激活的Cas13a高劑量遞送帶來的安全風(fēng)險(xiǎn),仍需實(shí)現(xiàn)精準(zhǔn)的腫瘤定位。受小分子自組裝前藥體系的啟發(fā),具有“無載體"遞送特性的納米前藥能夠有效解決載藥量低、滲透性差、穩(wěn)定性不足、藥代動(dòng)力學(xué)特征不佳及副作用嚴(yán)重等缺陷。此外,納米組裝體有利于與兩親性染料結(jié)合,從而構(gòu)建出一體化的診療系統(tǒng)。
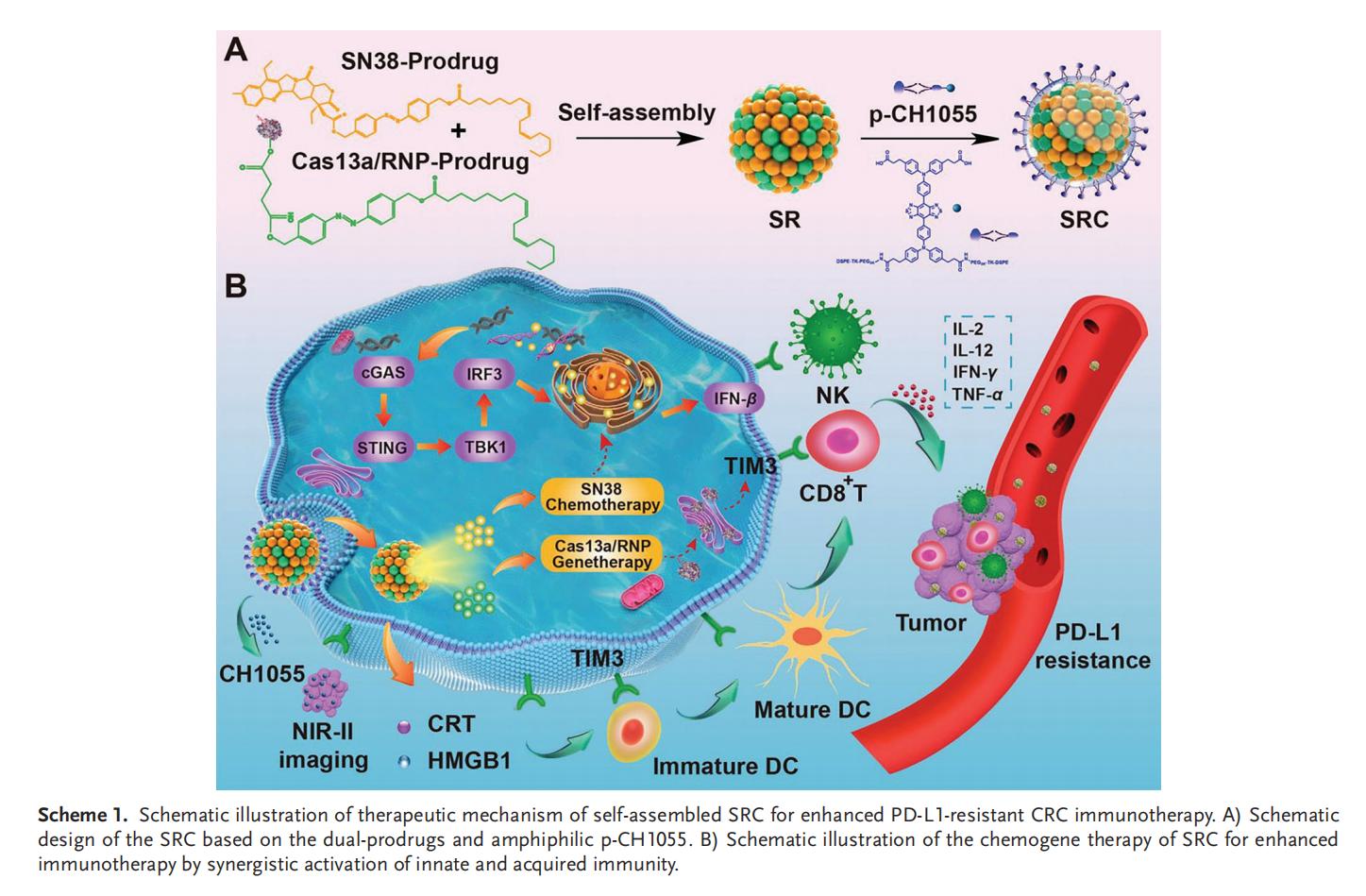
實(shí)驗(yàn)結(jié)果
1.SRC的制備和表征
本研究設(shè)計(jì)了一種級聯(lián)自解納米組裝體(SRC),其核心是由SN38前藥與靶向TIM3的Cas13a/RNP前藥自組裝形成的超分子納米復(fù)合物(SR),在外層包裹低濃度兩親性的DSPE-TK-PEG-CH1055(p-CH1055)作為納米系統(tǒng)表面涂層。亞油酸與偶氮苯的共軛作用促進(jìn)了SN38和Cas13a/RNP的自組裝及控釋,而琥珀酸酐的引入則增強(qiáng)了Cas13a/RNP的結(jié)合能力。聚不飽和脂肪酸無需外源輔料即可實(shí)現(xiàn)自組裝,其中亞油酸還被證實(shí)能確保集成自組裝體系在體內(nèi)保持高穩(wěn)定性,避免快速解聚和代謝。通過將疏水性CH1055轉(zhuǎn)化為兩親性探針的p-CH1055,不僅實(shí)現(xiàn)了腫瘤成像功能,還顯著提升了SRC的體內(nèi)穩(wěn)定性、生物相容性和藥代動(dòng)力學(xué)特性。
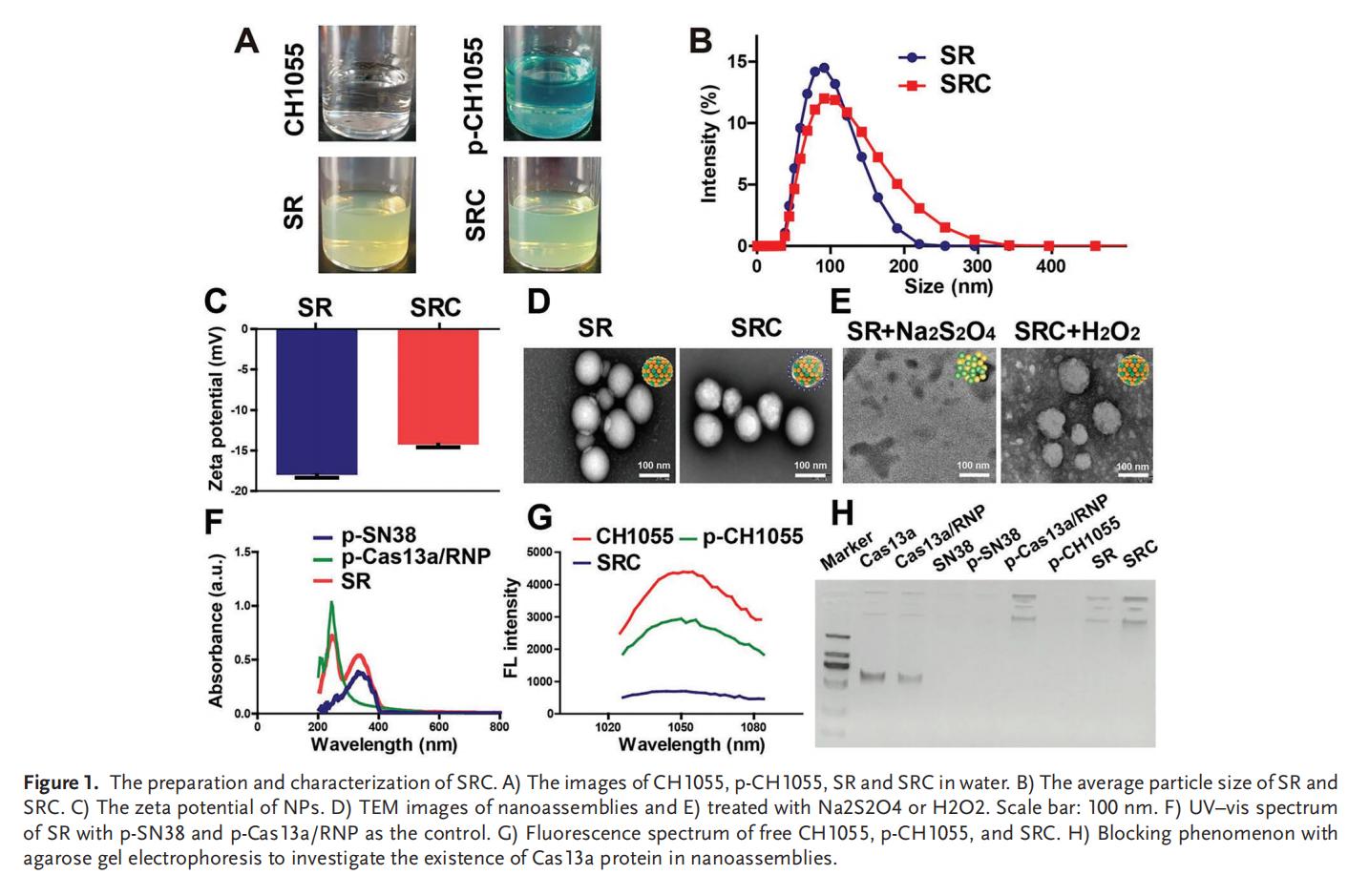
2.SRC的級聯(lián)自解與穩(wěn)定性
從“外殼"到“核心"的級聯(lián)自解過程始于對高活性氧(ROS)腫瘤微環(huán)境的響應(yīng),SRC在自解時(shí)釋放游離的CH1055,實(shí)現(xiàn)腫瘤的近紅外II(NIR-II)成像并阻止熒光淬滅;在第二次自解時(shí),由缺氧環(huán)境刺激SN38和Cas13a/RNP實(shí)現(xiàn)靶向控釋。
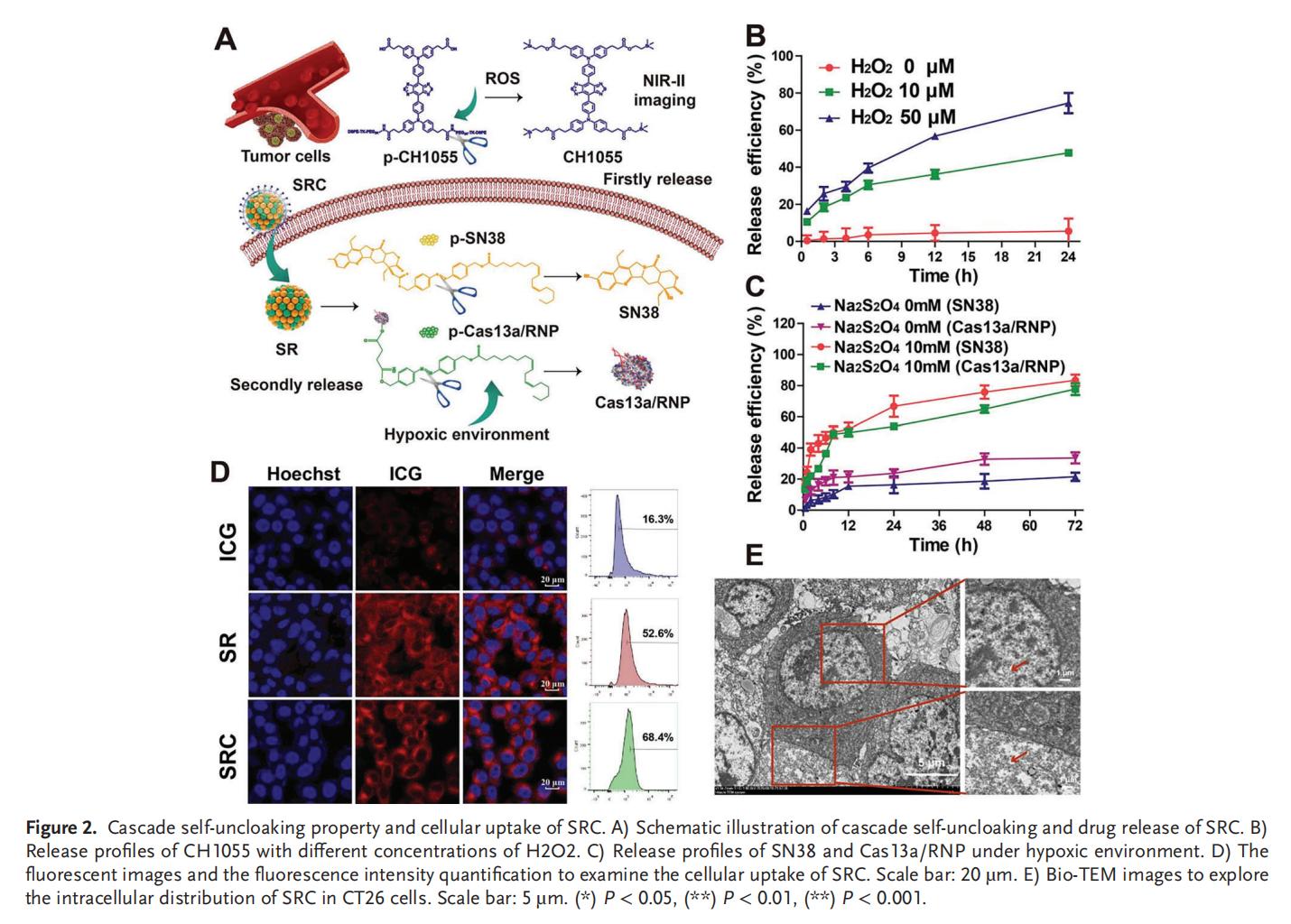
3.SRC和RNA編輯的高效細(xì)胞攝取
Cas13a/RNP在SRC中具有高活性,Cas13a核糖核蛋白復(fù)合物(RNP)的功能性和高RNA編輯效率使其能夠被應(yīng)用于癌癥治療。此外,SRC在RNA的編輯效率上優(yōu)于siRNA和脂質(zhì)轉(zhuǎn)染,這種差異可能源于納米系統(tǒng)更強(qiáng)的細(xì)胞攝取能力。
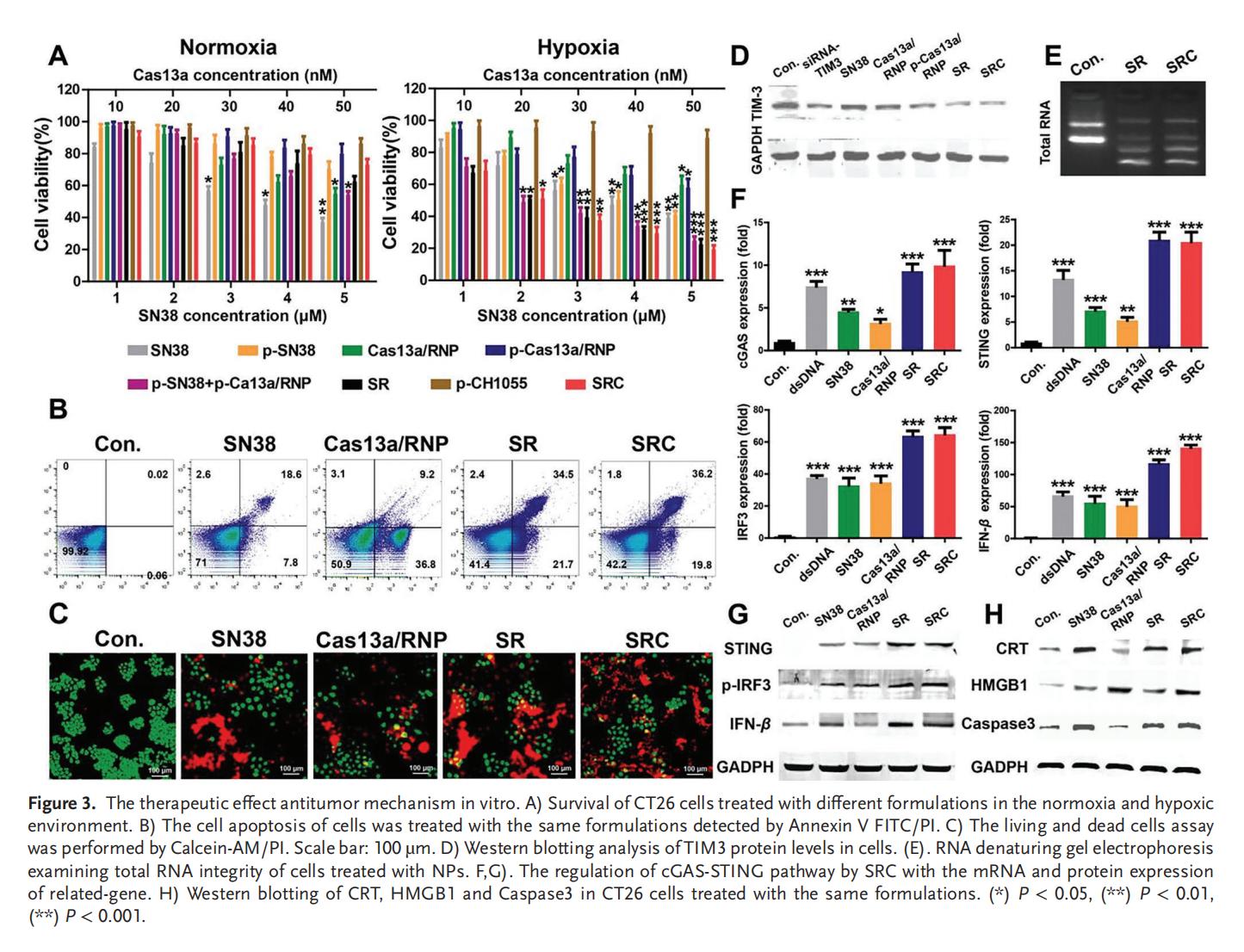
4.SRC的細(xì)胞毒性及抗腫瘤作用機(jī)制
Cas13a能夠通過高效的RNA降解顯著抑制TIM3的表達(dá)。SN38和Cas13a/RNP均能調(diào)控STING信號通路,顯著上調(diào)STING通路的相關(guān)蛋白,并且相較于單獨(dú)使用,SRC組合表現(xiàn)出更顯著的協(xié)同激活效應(yīng)。此外,SRC通過激活CRT、HMGB1及Caspase 3等誘導(dǎo)免疫細(xì)胞死亡效應(yīng),證實(shí)了SRC對低氧CRC細(xì)胞的體外療效,為CRC的治療提供了初步依據(jù)。
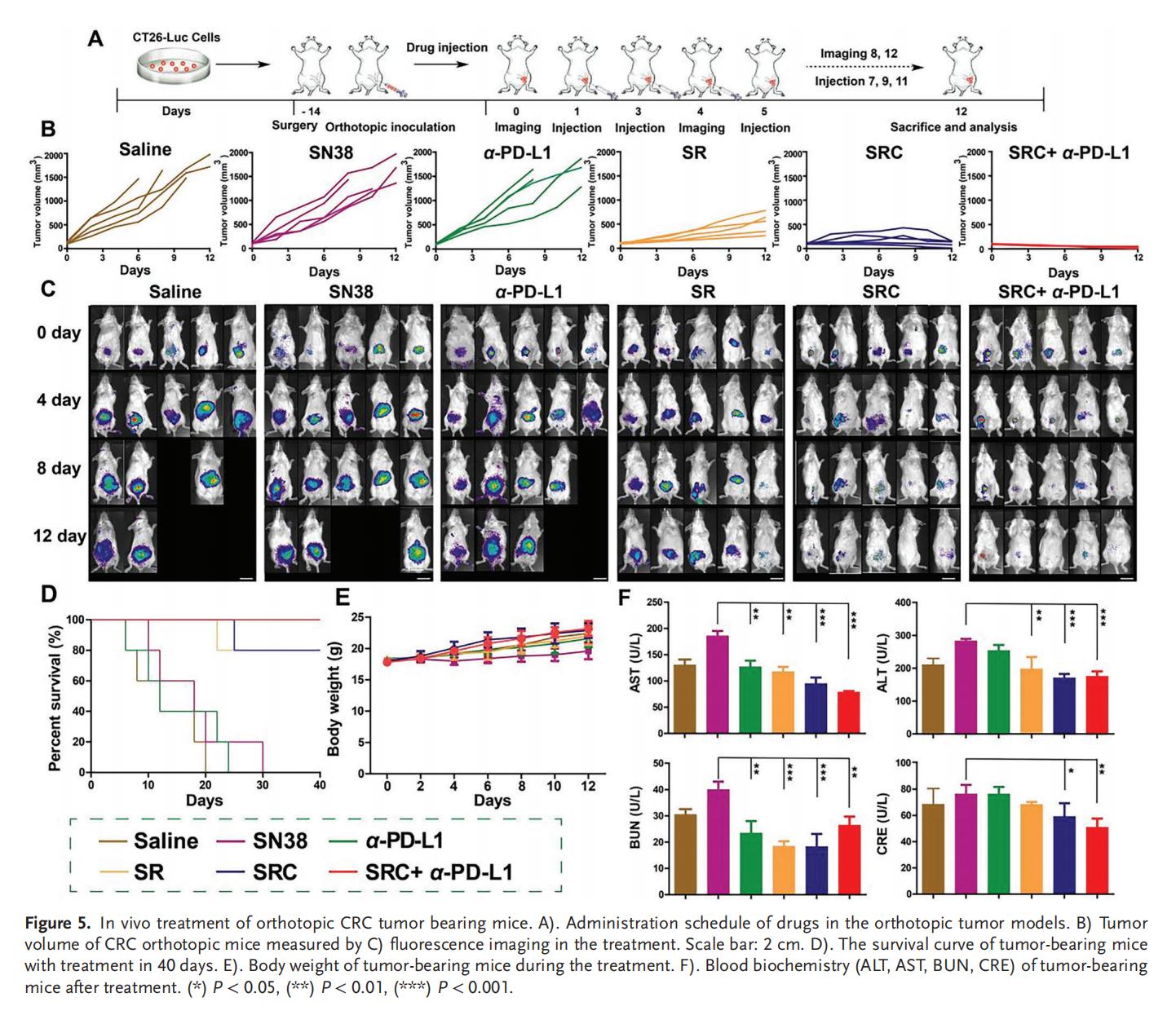
5.PD-L1耐藥CRC的體內(nèi)治療
單獨(dú)使用SN38或α-PD-L1治療僅表現(xiàn)出輕微的抗腫瘤效果,而SRC+α-PD-L1聯(lián)合治療則展現(xiàn)出最佳的腫瘤抑制效果,腫瘤細(xì)胞死亡率和凋亡水平以及小鼠存活率均顯著優(yōu)于單獨(dú)使用游離藥物或SR,并且具有高生物安全性。SRC優(yōu)異的治療效果和生物安全性表明其作為新型輔助治療策略,在增強(qiáng)PD-L1靶向ICB療法治療CRC方面具有巨大潛力。
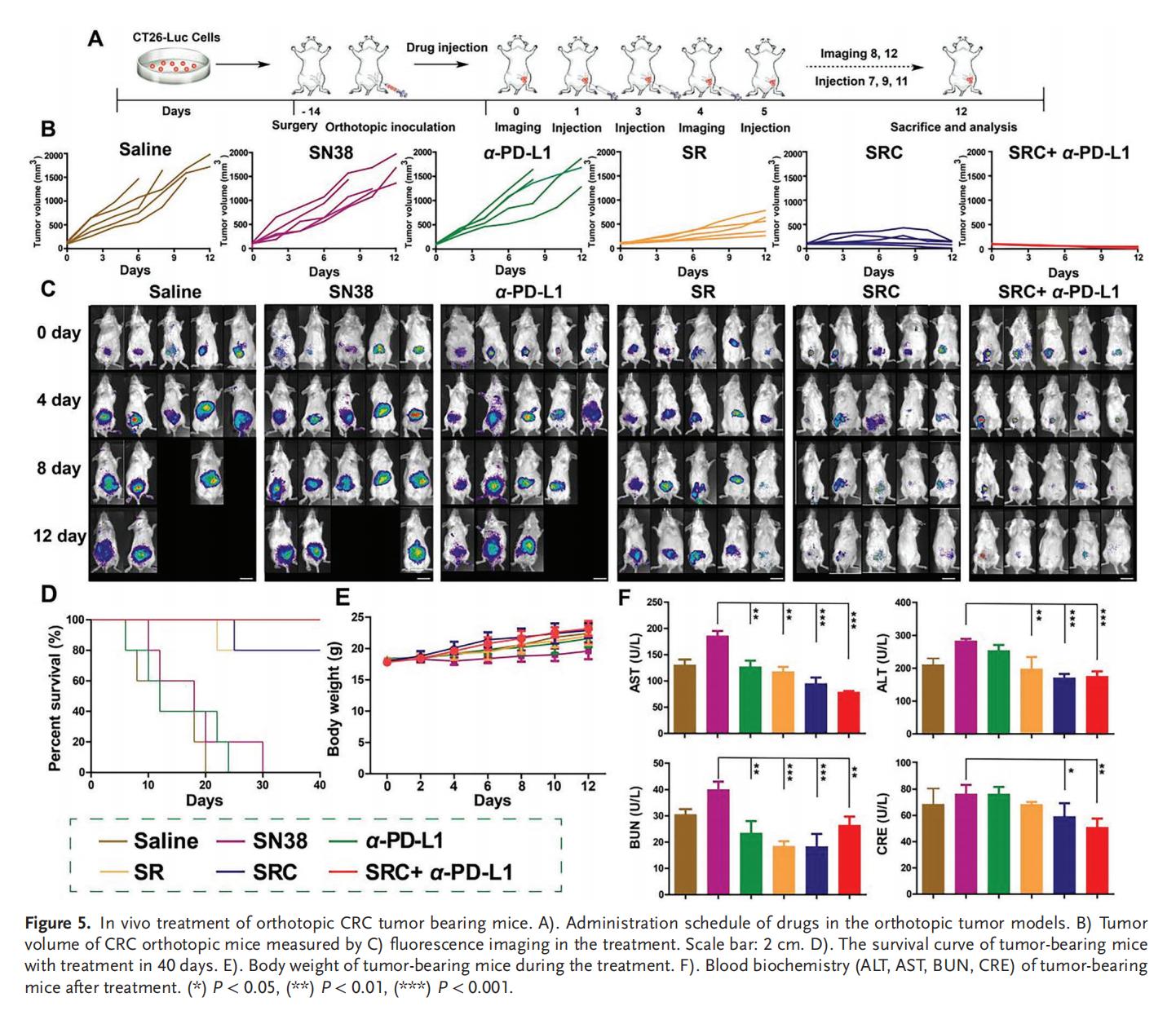
6.RNA測序分析
SRC對免疫激活和趨化因子分泌起到同樣的促進(jìn)作用,通過上調(diào)多種基因的轉(zhuǎn)錄水平,有效激活免疫系統(tǒng),此過程涉及多種信號通路,包括與Th1和Th2細(xì)胞分化相關(guān)的免疫通路、IgA生成、細(xì)胞因子受體、A2AR及IL-17信號傳導(dǎo),以及細(xì)胞周期調(diào)控、細(xì)胞增殖、細(xì)胞死亡、細(xì)胞凋亡相關(guān)通路等。此外,SN38的免疫原性細(xì)胞死亡(ICD)效應(yīng)可以誘導(dǎo)DNA修復(fù),不僅參與調(diào)控cGAS-STING信號通路,還影響抗原的加工與呈遞過程,為免疫系統(tǒng)提供特異性腫瘤抗原。SRC+α-PD-L1聯(lián)合治療在先天性免疫和獲得性免疫中均表現(xiàn)出了協(xié)同效應(yīng),通過先天性免疫系統(tǒng)與適應(yīng)性免疫系統(tǒng)的多效聯(lián)合作戰(zhàn),促進(jìn)細(xì)胞毒性T淋巴細(xì)胞浸潤腫瘤,逆轉(zhuǎn)ITM效應(yīng),從而有效抑制腫瘤生長。
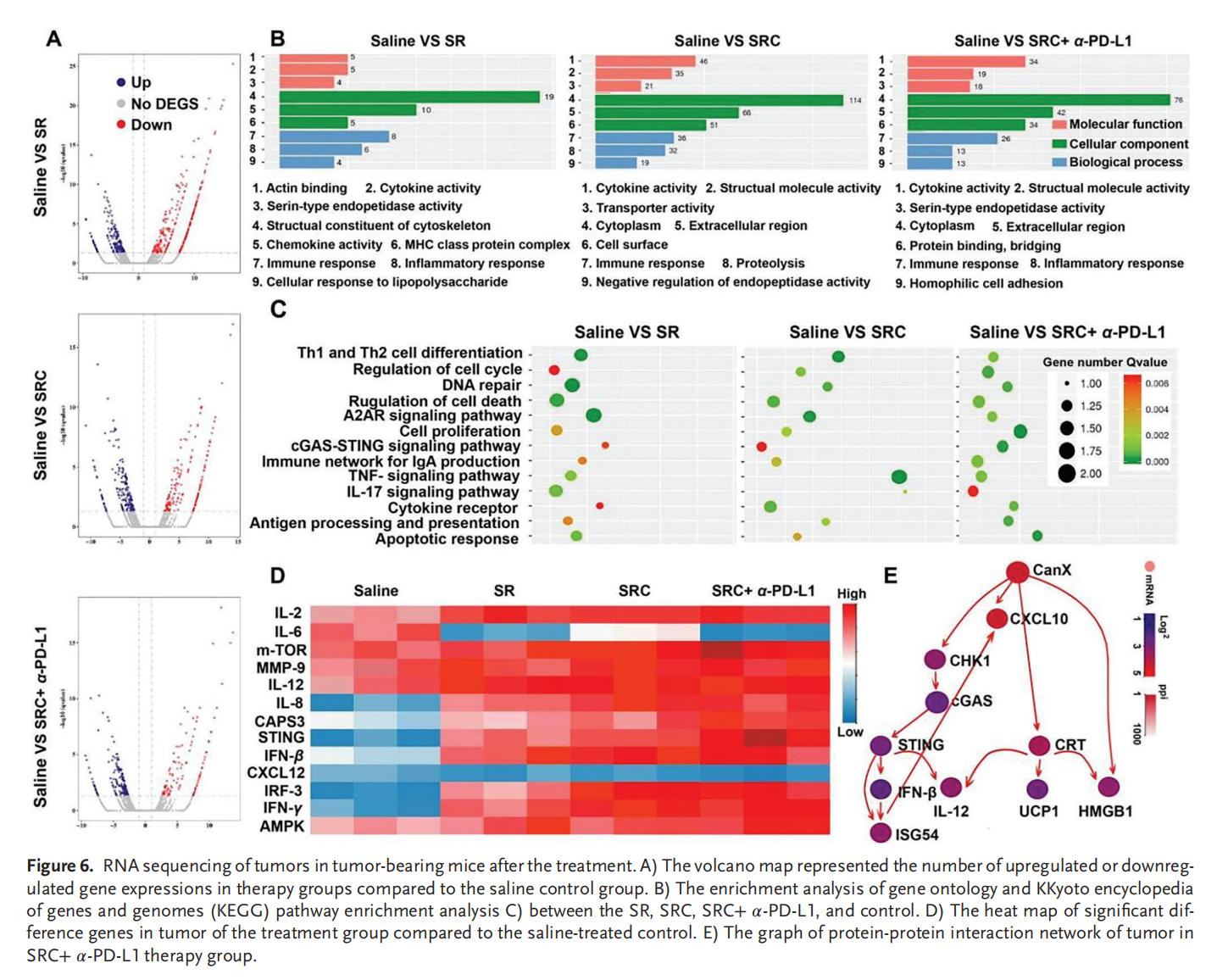
7.聯(lián)合治療的協(xié)同免疫激活
SN38誘導(dǎo)腫瘤細(xì)胞DNA斷裂,并觸發(fā)NK細(xì)胞活化和樹突狀細(xì)胞成熟。基于SN38與TIM3基因編輯技術(shù)的SRC組合療法具有顯著的免疫協(xié)同效應(yīng),SRC作為新輔助治療方案與已獲批的PD-L1靶向臨床藥物聯(lián)用時(shí)展現(xiàn)出優(yōu)異的療效。該策略通過先天免疫與獲得性免疫的聯(lián)合作戰(zhàn)為高效的免疫治療開辟了新途徑,有望突破CRC的ITM及PD-L1耐藥性,實(shí)現(xiàn)治愈。
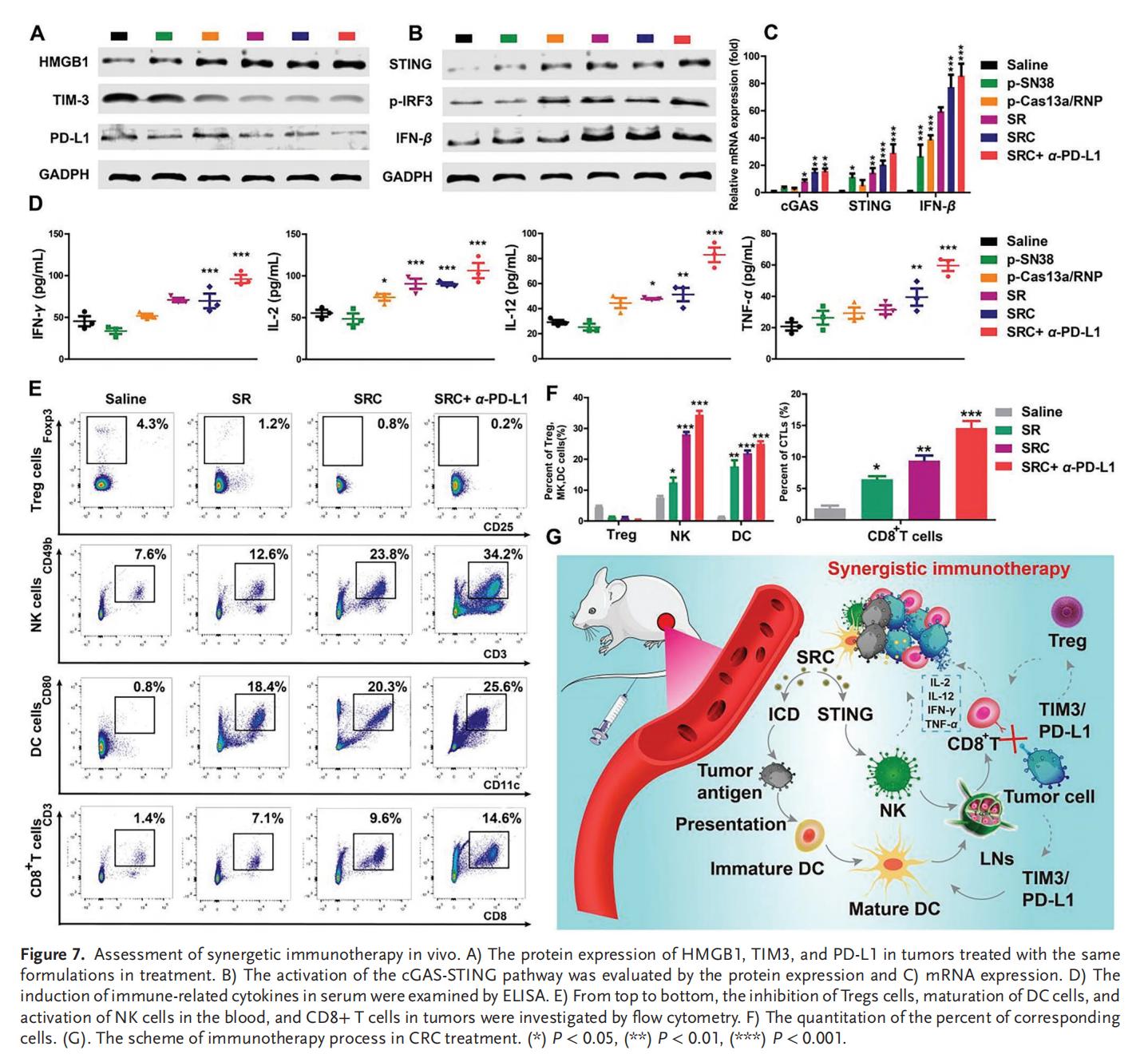
結(jié)論
本研究開發(fā)了一種基于SN38與Cas13a/RNP雙前藥的級聯(lián)自解納米組裝體SRC,通過包裹ROS響應(yīng)探針實(shí)現(xiàn)外部封裝。SRC不僅穩(wěn)定性優(yōu)異,還能根據(jù)腫瘤微環(huán)境的高ROS和低氧特性實(shí)現(xiàn)級聯(lián)自解響應(yīng):該探針在腫瘤微環(huán)境中被激活后,會因解離為單分子而觸發(fā)CH1055的近紅外II期成像,在缺氧環(huán)境中的二次自解可實(shí)現(xiàn)SN38和Cas13a/RNP的靶向控釋。
在體外實(shí)驗(yàn)中,SRC成功實(shí)現(xiàn)了CRC細(xì)胞的高效攝取和靶向基因編輯。Cas13a蛋白通過旁系切割效應(yīng),有效抑制了癌細(xì)胞增殖并誘導(dǎo)其凋亡。此外,在PD-L1耐藥的原位和異種移植模型中,SRC展現(xiàn)出優(yōu)異的CRC抑制效果,通過增強(qiáng)CTL介導(dǎo)的腫瘤免疫浸潤,顯著提升α-PD-L1抗體在體內(nèi)的治療效果。SRC還能誘導(dǎo)細(xì)胞介導(dǎo)的ICD,激活cGAS-STING先天免疫通路,促進(jìn)樹突狀細(xì)胞成熟、NK細(xì)胞增殖,通過靶向調(diào)控新型免疫檢查點(diǎn)TIM3的RNA編輯技術(shù),協(xié)同激活先天性和適應(yīng)性免疫系統(tǒng),顯著改善ITM。
總之,SRC為SN38化療與TIM3基因治療的聯(lián)合應(yīng)用提供了高效策略,這種結(jié)合方案有望在降低副作用的同時(shí)增強(qiáng)PD-L1抗體治療效果。因此,該技術(shù)在未來PD-1耐藥CRC的臨床治療中具有良好的應(yīng)用潛力。