歡迎來到北京博奧森生物技術有限公司網站!
歡迎來到北京博奧森生物技術有限公司網站! 歡迎來到北京博奧森生物技術有限公司網站!
歡迎來到北京博奧森生物技術有限公司網站!

在基因功能研究和疾病機制探索中,基因敲除(KO)技術已成重要的科研工具。為滿足科研工作者對高質量KO模型的需求,我們推出了一系列經嚴格驗證的KO細胞系及配套裂解液產品,覆蓋多種熱門靶點,助力您的研究更高效、更精準!
產品優勢
定制化服務:支持熱門靶點快速交付,也可根據需求定制特定基因KO細胞模型,涵蓋Hela、HEK293T、A549、HCT116、Hep G2和MCF7等KO細胞系,靈活滿足科研需求。
產品展示
Bioss 的KO系列產品仍在持續研發更新驗證中,本期為大家帶來8月上新及推薦的KO細胞系和對應的裂解液產品,請欣賞我們的驗證數據~
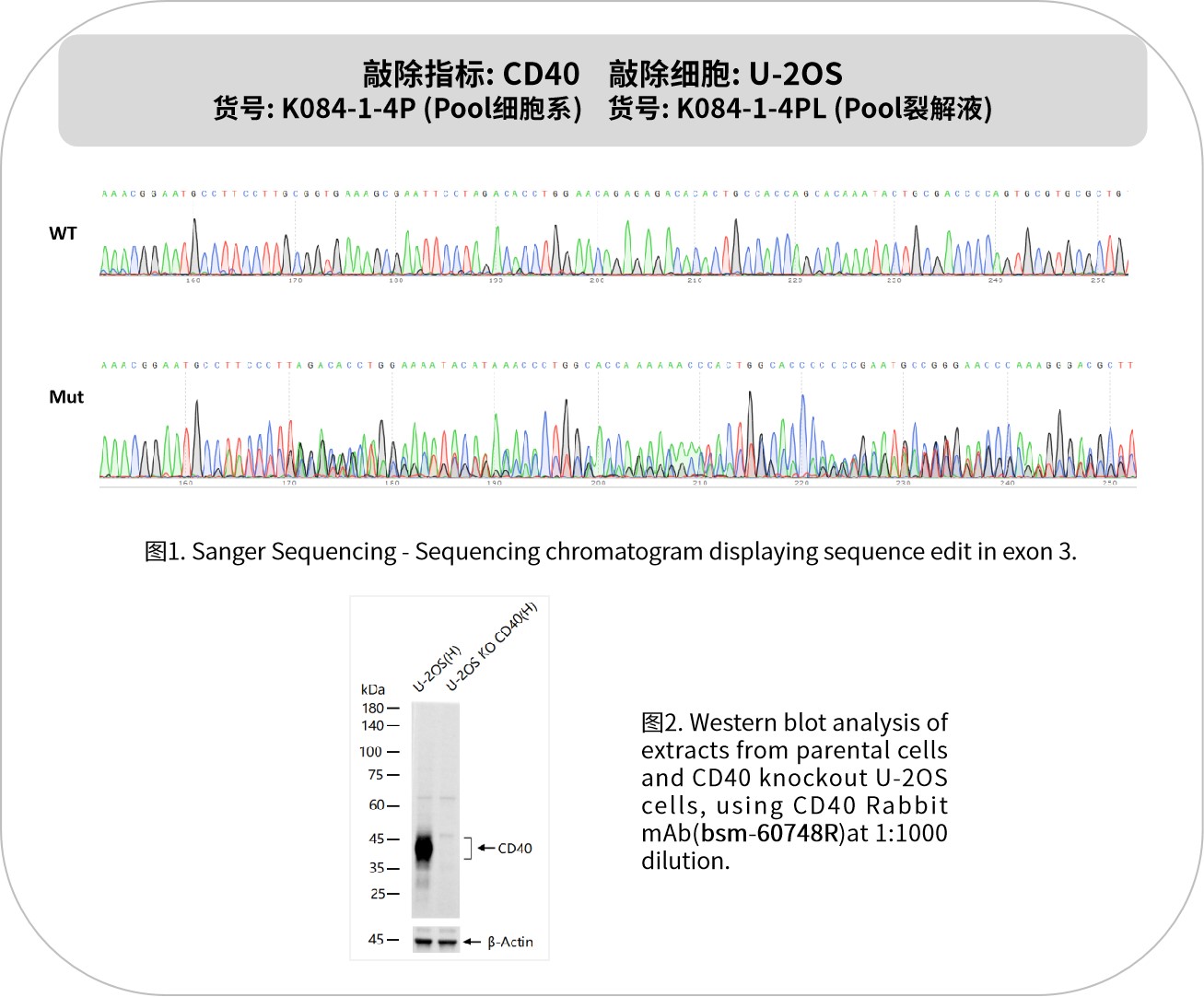
CD40是一種關鍵的免疫共刺激分子,屬于腫瘤壞死因子受體超家族(TNFRSF)成員。主要分布于B細胞、樹突狀細胞(DC)、單核細胞、巨噬細胞等免疫細胞。CD40與CD40L結合后,激活B細胞增殖、抗體類別轉換(如IgM→IgG/IgA/IgE),促進記憶B細胞生成;增強樹突狀細胞成熟,上調MHC II類分子和共刺激分子表達,增強抗原呈遞能力;誘導巨噬細胞分泌炎癥因子(如TNF-α、IL-12),增強吞噬能力。CD40還參與T細胞與B細胞的相互作用,促進T細胞極化(如TH1/TH2平衡),調節免疫應答的強度和方向。CD40激動劑通過激活免疫應答增強抗腫瘤效果,多項激動劑藥物已進入臨床研究;而在自身免疫疾病領域,抑制CD40信號則顯示出潛在的治療價值。
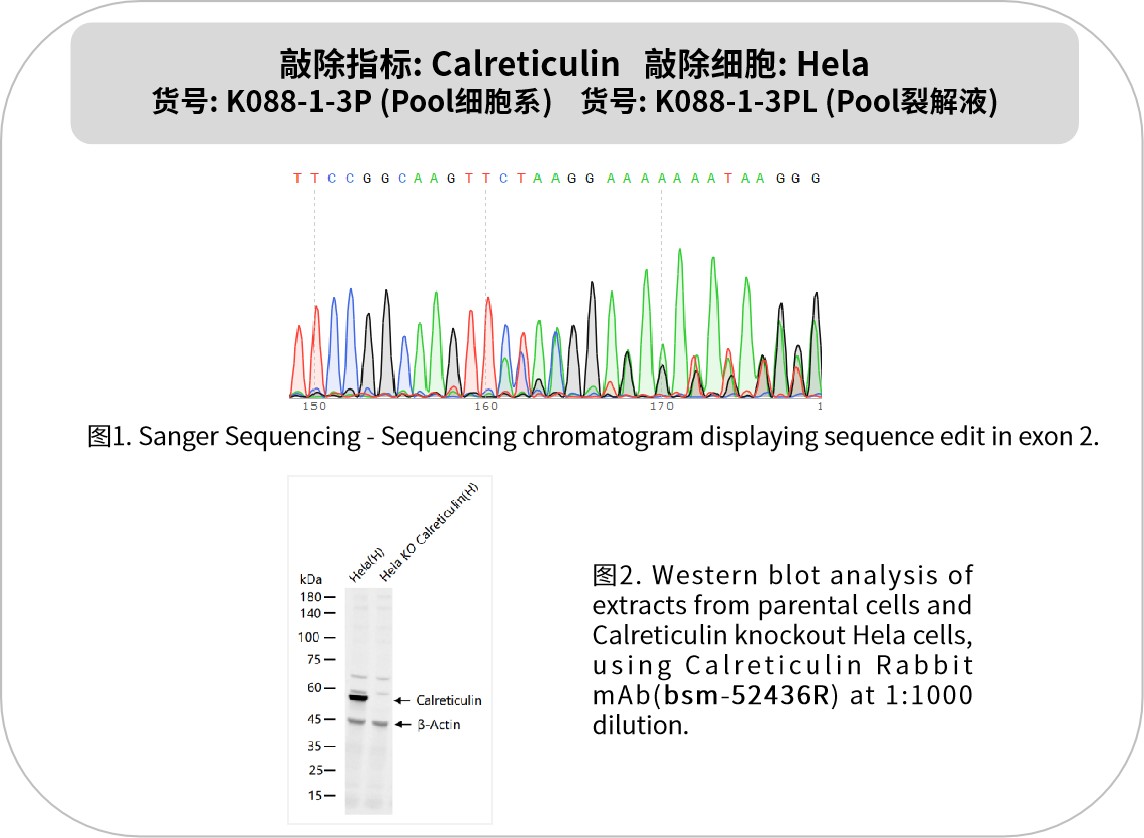
鈣網蛋白(Calreticulin, CRT)是內質網核心伴侶蛋白,通過調控蛋白質折疊、鈣穩態及免疫信號傳遞,在腫瘤、免疫應答和細胞應激中發揮關鍵作用。作為腫瘤免疫監視的核心標志物,CRT膜轉位可激活自然殺傷(NK)細胞并促進樹突狀細胞(DC)抗原呈遞,顯著增強免疫檢查點抑制劑療效。例如,奧沙利鉑等化療藥物通過誘導CRT暴露,提升腫瘤細胞免疫原性,臨床數據顯示CRT表達水平與彌漫大B細胞淋巴瘤預后密切相關。在腫瘤微環境中,CRT通過調節TGF-β信號通路和調節性T細胞(Treg)擴增,影響免疫逃逸機制。靶向CRT/TGF-β軸可恢復T細胞活性,為骨髓增生性腫瘤等治療提供新策略。此外,CRT在食管鱗癌等實體瘤中高表達,與浸潤深度及轉移呈正相關,是潛在的診斷標志物。
帕金森病(Parkinson's Disease, PD)是全球兩大神經退行性疾病,也是最常見的與年齡相關的神經運動障礙。帕金森病的主要特征是中腦黑質致密部的多巴胺神經元喪失,伴隨α-突觸核蛋白(α-synuclein, 簡稱α-syn)異常聚集,形成路易小體和路易神經突。
α-synuclein是一種天然無序蛋白,廣泛存在于神經元中,特別是在突觸囊泡內。它在突觸囊泡中具有較高的濃度,也可在細胞質中以未折疊的單體形式存在。在正常條件下,α-synuclein以可溶、動態的形式存在,參與突觸囊泡的維持及神經信號的傳遞。在帕金森病的發病過程中,α-synuclein發生錯誤折疊,形成不溶性的聚集體,這些聚集體包括寡聚體、原纖維和淀粉樣纖維。錯誤折疊后的α-synuclein聚集體具有毒性,能夠破壞神經元功能,導致神經炎癥,并最終導致神經元死亡。α-synuclein的聚集是帕金森病的關鍵病理特征之一。

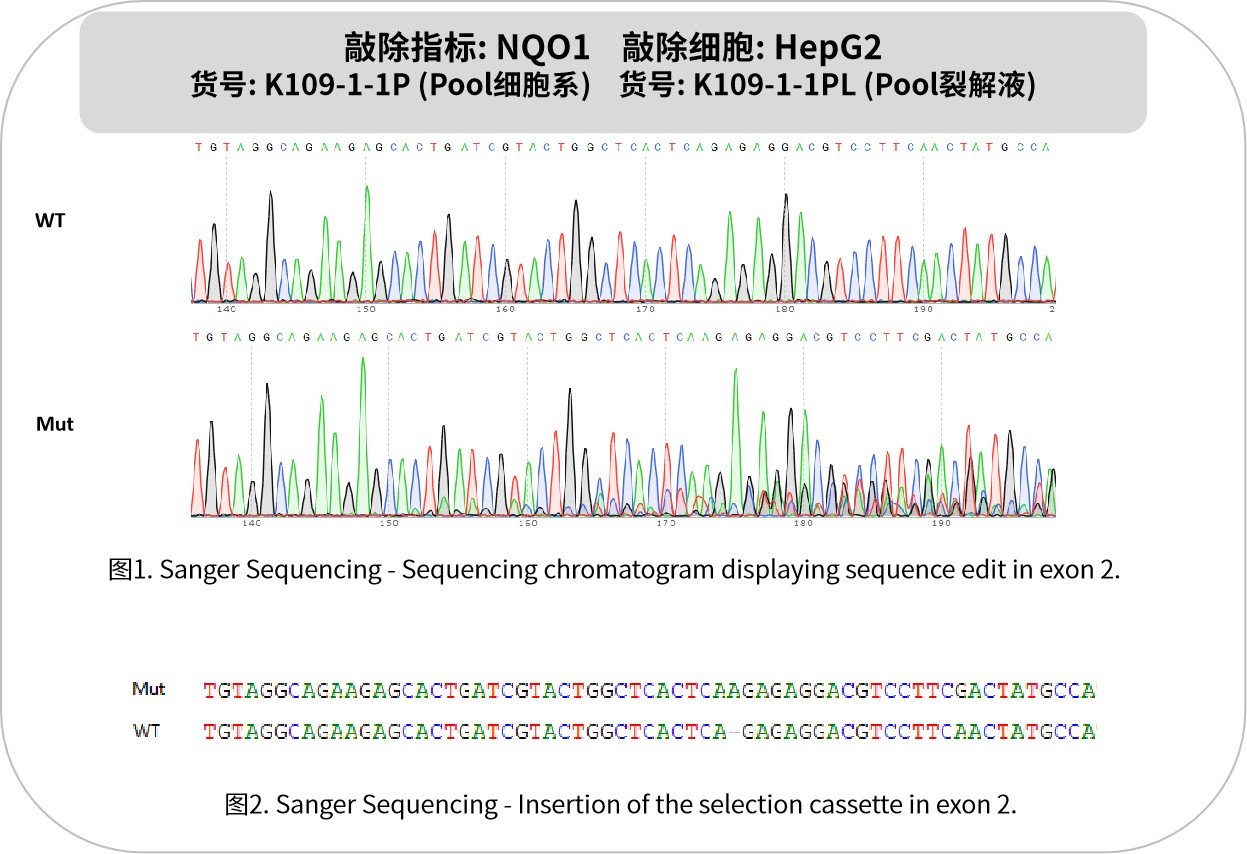
NQO1是一種雙電子氧化還原酶,主要催化醌類化合物的還原反應,參與細胞內有害物質的解毒過程。它以NADH或NADPH為輔酶,將醌類化合物還原為無害的二羥基化合物,從而保護細胞免受氧化損傷。NQO1在多種腫瘤組織中表達顯著上調,如肺癌、肝癌、結直腸癌、膠質母細胞瘤等。這種高表達與腫瘤細胞的增殖、侵襲和耐藥性密切相關,使其成為腫瘤治療的潛在靶點。其抗腫瘤機制主要包括:特異性激活前藥(如吲哚醌類化合物),在腫瘤細胞內釋放活性成分誘導凋亡;調控鐵死亡和代謝過程,通過破壞氧化還原平衡選擇性殺傷腫瘤細胞;調節免疫應答,增強免疫治療效果。
MSI2(Musashi2)是一種重要的RNA結合蛋白,作為致癌因子在多種血液腫瘤和實體瘤(如AML、結直腸癌、肺癌等)中顯著高表達,且與患者預后不良密切相關。它通過其RNA識別基序(RRM)與靶標mRNA(如Numbl、p21等)的3'非翻譯區結合,進而抑制翻譯或調節mRNA穩定性,從而精細調控基因表達。這一機制激活了多條關鍵致癌通路,包括mTORC1信號、Wnt/β-catenin和Notch通路,有效促進腫瘤細胞增殖、侵襲并維持腫瘤干細胞特性。此外,MSI2還通過增強DNA損傷修復能力(如激活ATM/CHEK2通路)及抑制凋亡,顯著介導了對化療、放療及靶向治療的耐藥性。

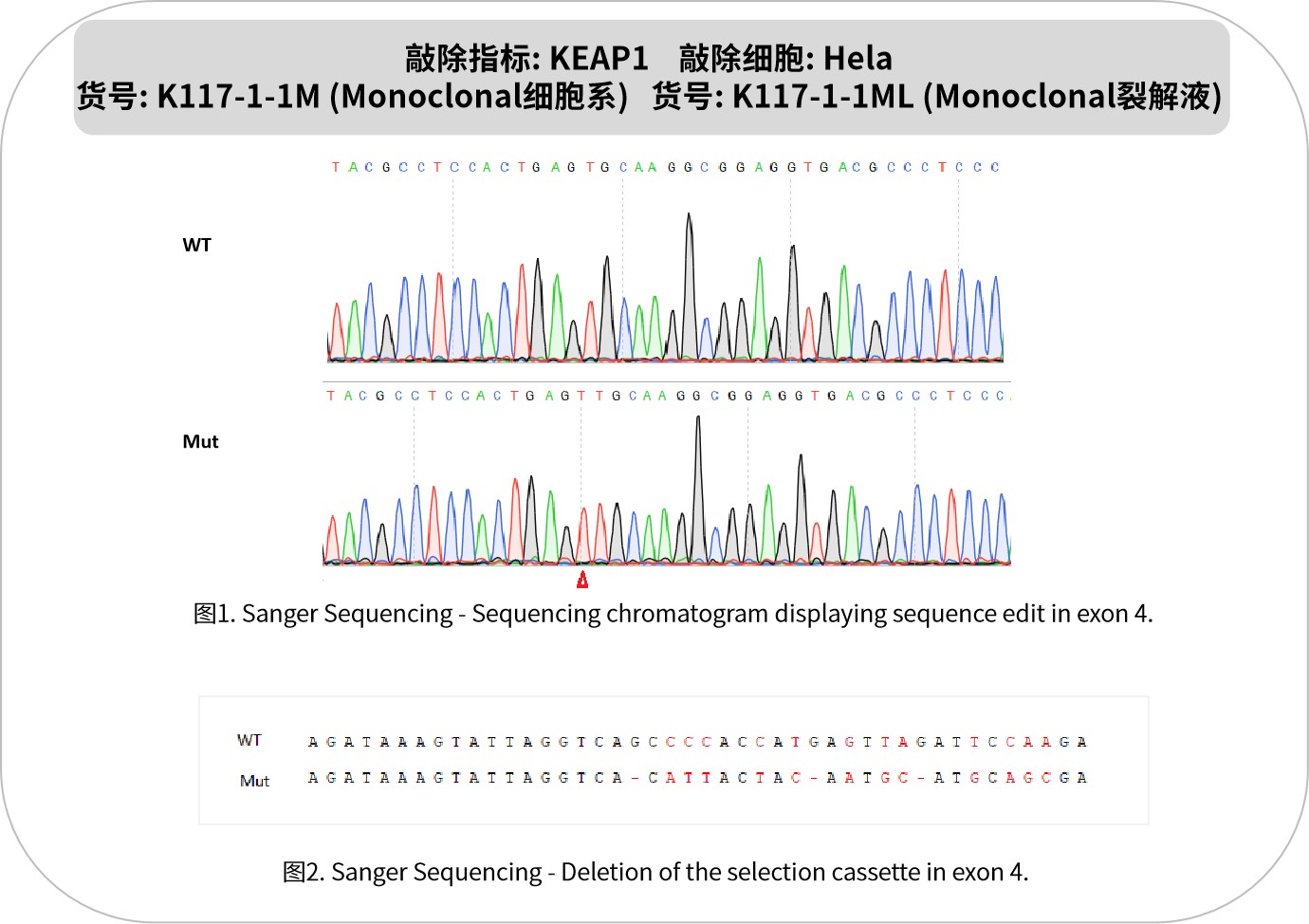
KEAP1是細胞抗氧化應激響應的關鍵調控蛋白,作為Cullin3泛素連接酶復合物的底物識別組分,主要負責調控轉錄因子NRF2的穩定性。在正常情況下,KEAP1介導NRF2的泛素化降解;當細胞遭遇氧化應激時,KEAP1構象改變導致NRF2釋放入核,激活抗氧化基因表達,增強細胞抗氧化防御能力。在病理狀態下,KEAP1功能喪失性突變或表達異常可導致NRF2通路持續激活,促進腫瘤進展、化療耐藥和免疫逃逸,尤其在非小細胞肺癌等惡性腫瘤中常見。該通路還參與慢性腎病和神經退行性疾病的發生。開發KEAP1抑制劑或NRF2激活劑是治療相關疾病的重要方向。